产品展示NAVIGATION

电话:
传真:-8008
QQ:3007536035
地址:上海市闵行区兴梅路485号 XingMei Rd 485ShanghaiChina
颅内给药导管
时间:2021-06-10来源:本站作者:金年会仪器
详细介绍
ALZET微渗透压泵通过脑输注附件套,进行直接的脑部药物输注。已经有成百上千关于神经科学的文献发表,输注的药物包括生长因子,siRNA,精神药物等。
| ALZET Brain Infusion Kit 1 | ALZET Brain Infusion Kit 2 | ALZET Brain Infusion Kit 3 |
|---|---|---|
|
Order number: 0004760 |
Order number: 0008663 |
Order number: 0008851 |
|
|
|
|
|
注:所有材料包满足美国药典(USP)第六类标准医疗塑料的生物相容性。 |
||
根据需要,可以选购渗透给药胶囊Osmotic Pump 与导管配套使用
大鼠、小鼠植入式微量给药渗透压胶囊(泵)ALZET Osmotic Pump体积小巧,可植入大鼠、小鼠的皮下或腹腔内,直接或通过导管将药物持续、准确地注射到指定部位,选择合适的型号,缓释给药时间可以达到3天到42天。

已得到广泛的应用:
· 用ALZET® Osmotic Pumps 发表的科学论文已达一万多篇;
· 采用ALZET给药胶囊进行药理生理及毒理实验的国内研究机构、大学、药厂实验室已达上千家;
· 在生命科学研究领域,ALZET给药胶囊己成为在药物注射工作中省时、省力的的良好工具;

产品主要应用:
· ALZET给药胶囊符合USP医疗用塑胶材料生物兼容性标准,适合植入动物体内,针对特定部位给药;
· ALZET给药胶囊搭配导管可将药物注射到指定部位:脊髓及颅腔内,血管内、肝脏、脾脏、脑室及其它脏器和创伤处;
· 在全球各地八千多项生命科学实验研究中,ALZET给药胶囊已成功的运送数百种药剂,包括蛋白质,多肽,生长因子,基因研究及治疗中的Antisense和新的干扰 RNA(RNAi)、抗生素、化疗药、激素、类固醇及其它短效期的化合物;
· 在心血管疾病及神经系统疾病的研究中,ALZET给药胶囊持续给药可以建立多种疾病的动物模型,如高血压及 Parkinson 帕金森病的动物模型等等;
可将药剂用导管导入到不同部位, 例如: 颅腔及脊髓内, 血管内, 肝脏,脾脏及其它脏器和创伤处。

如果需要特点的药物注射部分,可以连接合适的导管开展缓释给药工作,如:大鼠颈静脉导管、大鼠股动脉导管、大鼠鞘内导管、小鼠颈静脉导管、小鼠鞘内导管
给药导管主要用于大小鼠鞘内给药使用,可以配合ALZET胶囊渗透压泵,直接将鞘内给药导管埋入脊髓相应的位置,进行持续的、精准位置给药;除了可以注射到脊髓鞘内,也可用于大小鼠血管,脑室和其他组织、器官的指定部位,进行持续的定量定位置给药。
通过使用导管,ALZET 给药胶囊可以将药物输送到血管、脊髓、脑室和脑实质以及其他器官或组织内。DURECT公司提供一系列与ALZET泵兼容的专用导管,以实现对各种部位的定向输送。ALZET泵可以连接到直径从0.58mm到0.76mm(0.023”-0.030”)的导管上。
医用级PE和乙烯基管是实验动物研究中最常见的导管类型,可提供无菌、单独包装和随时可用的导管。
需要使用导管给药的常见部位:
关节腔、血管内、骨头、脑实质、脑室、耳朵、眼睛、肌肉、神经、脊髓、胃部、肿瘤
聚乙烯和乙烯基导管规格:
| 描述 | 型号 | 长度 | 外径 | 内径 | 容量 | 包装和数量 |
| 乙烯基导管 | 7760 | 15cm | 1.14 mm | 0.69 mm | 3.739 µl/cm | 每包10根 |
| 聚乙烯导管 | 7750 | 15cm | 1.22 mm | 0.76 mm | 4.566 µl/cm | 每包10根 |
注意:当需要全身给药时不需要导管,可通过皮下或腹膜内植入无导管的ALZET渗透泵来完成。
这些导管专门设计用于所有型号的ALZET渗透泵,其远端定制用于特定目标(静脉内、鞘内、腹膜内)和动物物种(小鼠和大鼠)。这些导管具有实用的特点,例如固位珠或缝合补片,以便于在血管或组织中的放置和稳定。为了更加方便地使用,导管都是无菌的单独包装
|
|
|
 |
大鼠颈静脉导管 Rat Jugular Catheter 型号:0007710 导管材质:硅胶
规格:硅胶导管,长度15.24cm(6”), (0.94 OD;0.51 mm ID),具有硅胶缝合补片,连接端(1.19 mm OD; 0.61 mm ID),导管内容量约32-36μl。 适合动物大小:250克以上的大鼠(对于小于250克的大鼠,可裁剪成合适的长度以达到最佳位置)。
特点与优点: · 硅胶补片有助于导管固定在组织上; · 硅胶材料非常灵活,对血管的损伤较小; · 可选择斜面尖端,以便于插入血管; · 环氧乙烷灭菌;
|
|
|
|
|
|
|
 |
大鼠股动脉导管 Rat Femoral Catheter 型号:0007720 导管材质:聚氨酯(PU)
规格:聚氨酯导管,长度20.32 cm (8″) ,(1.02 mm OD; 0.61 mm ID),专为静脉插管设计,导管内容量约59μl
适合动物大小:可达300克以上大鼠(对于<175克的大鼠,可裁剪成合适的长度以达到最佳位置)
特点与优点: · 位于尖端3.81、5.08和7.62 cm处的固位珠有助于导管固定到组织; · 医用级聚氨酯材质会在体温下变软; · 可直接安装在渗透泵上;
|
|
|
|
|
|
|
 |
大鼠股动脉导管(锥形) Rat Femoral Catheter (Tapered) 型号:0007730(定制订单) 导管材质:不透明聚氨酯
规格:锥形不透明聚氨酯导管,长度20.32 cm (8″),(1.40 - 0.99 mm OD; 0.61 mm ID);专为静脉插管设计,导管内容量约59μl 适合动物大小:可达300克以上大鼠(对于<175克的大鼠,可裁剪成合适的长度以达到最佳位置)
特点与优点: · 位于尖端3.81、5.08和7.62 cm处的固位珠有助于导管固定到组织; · 医用级锥形聚氨酯可最大限度地减少扭结; · 不透光材料和光滑的表面可最大限度地减少凝血; · 导管具有一致的内径,使得可以剪裁导管而不影响其与泵的紧密贴合;
|
|
|
|
|
|
|
 |
大鼠鞘内导管 Rat Intrathecal Catheter 型号:0007740 导管材质:聚氨酯(PU)
规格:具有特氟龙涂层的导管总长为23.7 cm (9.33″),分别由10 cm的PU导管 (0.36 mm OD; 0.18 mm ID) ,12.7 cm的PU导管 (0.84 mm OD; 0.36 mm ID) 和连接端 (1.02 mm OD; 0.61 mm ID) 组成,导管内容量约20μl。 适合动物大小:可达300克以上大鼠(可裁剪成合适的长度以达到最佳位置)
特点与优点: · 专为枕部插入而设计; · 具有特氟龙涂层,使导管更容易放置; · 受保护的连接端最大限度地减少了鞘内间隙出口处的扭结;
|
|
|
|
|
|
|
 |
大鼠鞘内导管(短款) Rat Intrathecal Catheter (Short) 型号:0007741 导管材质:聚氨酯(PU)
规格:具有特氟龙涂层的导管总长为15.0 cm (5.90″),分别由10 cm的PU导管 (0.36 mm OD; 0.18 mm ID) ,4.0 cm的PU导管 (0.84 mm OD; 0.36 mm ID) 和连接端 (1.02 mm OD; 0.61 mm ID) 组成,导管内容量约10 - 11μl 适合动物大小:可达300克以上大鼠(可裁剪成合适的长度以达到最佳位置)
特点与优点: · 较短的长度适合腰椎插入; · 具有特氟龙涂层,使导管更容易放置; · 受保护的连接端最大限度地减少了鞘内间隙出口处的扭结;
|
|
|
|
|
|
|
 |
大鼠腹膜腔内导管Rat Intraperitoneal Catheter 型号:0007770 导管材料:硅胶和聚氨酯(PU)
规格:导管总长为8.0 cm,分别由5.0 cm 的硅胶导管 (0.94 mm OD; 0.51 mm ID) 与3.0 cm 的PU导管 (1.02 mm OD; 0.61 mm ID) 连接组成,硅胶端1.5cm出有开窗,导管内容量约19μl 应用: · 腹膜/胃给药; · 经皮下埋置渗透泵,进行腹膜输送; · 更易于渗透泵的更换;
特点与优点: · 硅胶尖端上的开窗可实现更大的药物分布; · 具有可移动缝合珠,可对插入的导管部分进行最佳调整; · 灵活的硅胶部分可最大限度地减少组织创伤; · 聚氨酯部分为所有ALZET泵型号提供最佳匹配,并可剪裁成所需的长度; · 压力释放导管连接可防止扭结并提高通畅性;
|
|
|
|
|
|
|
 |
小鼠颈静脉导管Mouse Jugular Catheter 型号:0007700 导管材料:聚氨酯(PU)
规格:导管总长为8.8 cm (3.46″),分别由13mm的PU导管 (0.36 mm OD; 0.18 mm ID),63.5mm 的PU导管 (0.84 mm OD; 0.36 mm ID) 和连接端(1.02 mm OD; 0.61 mm ID) 组成,导管内容量约10μl 最佳动物大小:30克以上的小鼠(亦可用于较小动物)
特点与优点: · 固位珠位于距尖端13 mm和38 mm处,有助于导管固定到组织; · 导管亦可用于其他小血管(如股动脉、颈动脉等); · 于9mm和11mm出有标记,以适应< 25克和25-30克的动物; |
|
|
|
|
|
|
 |
小鼠颈静脉导管(长度可调)Mouse Jugular Catheter (Adjustable Length) 型号:0007701 导管材料:聚氨酯(PU)
规格:导管总长为8.8 cm (3.46″),分别由13mm的PU导管 (0.36 mm OD; 0.18 mm ID),25.4mm 的PU导管 (0.84 mm OD; 0.36 mm ID) 和连接端(1.02 mm OD; 0.61 mm ID) 组成,导管内容量约18μl 最佳动物大小:30克以上的小鼠(亦可用于较小动物)
特点与优点: · 可裁剪成合适的长度以达到最佳位置; · 导管亦可用于其他小血管(如股动脉、颈动脉等); · 固位珠位于距尖端13 mm和35 mm处,有助于导管固定到组织; 于9mm和11mm出有标记,以适应< 25克和25-30克的动物;
|
|
|
|
|
|
|
 |
小鼠颈静脉导管(长度可调-更大尖端) Mouse Jugular Catheter (Adjustable Length-Large Tip) 型号:0007702 导管材料:聚氨酯(PU) 规格:导管总长为9.5 cm (3.74″),分别由44.5 mm的PU导管(0.84 mm OD; 0.36 mm ID)和连接端(1.02 mm OD; 0.61 mm ID) 组成,导管内容量约20μl
适合动物大小:30克以上的小鼠(亦可用于较小动物)
特点与优点: · 可裁剪成合适的长度以达到最佳位置; · 具有最适合颈静脉插管的导管尖端; · 固位珠位于距尖端13 mm和35 mm处,有助于导管固定到组织; · 于9mm和11mm出有标记,以适应< 25克和25-30克的动物;
|
|
|
|
|
|
|
 |
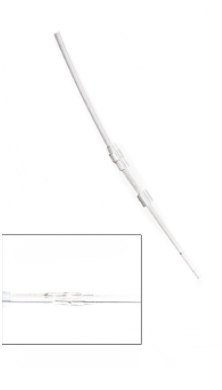
小鼠鞘内导管 Mouse Intrathecal Catheter 型号:0007743 导管材料:聚氨酯(PU) 规格:具有特氟龙涂层的导管总长为6 cm (2.36″),分别由2.5 cm的PU导管(0.23 mm OD; 0.09 mm ID),1 cm的PU导管 (0.86 mm OD; 0.38 mm ID)和连接端(1.02 mm OD; 0.61 mm ID) 组成,导管内容量约8.6μl。 最佳动物大小:成年小鼠。
特点与优点: · 可裁剪成合适的长度以达到最佳位置; · 具有特氟龙涂层,使导管更容易放置; · 无菌导管
|
|
|
|
|
|
|
 |
小鼠腹腔导管Mouse Intraperitoneal Catheter 型号:0007771 导管材料:硅胶和聚氨酯(PU)
规格:导管总长为6 cm (2.36″),分别由3.0 cm的硅胶导管 (0.94 mm OD; 0.51 mm ID) 与3.0 cm 的PU导管 (1.02 mm OD; 0.61 mm ID) 连接组成,硅胶段的顶端有开窗,导管内容量约15μl 适合动物大小:成年小鼠
特点与优点: · 硅胶尖端上的开窗可实现更大的药物分布; · 具有可移动缝合珠,可对插入的导管部分进行最佳调整; · 灵活的硅胶部分可最大限度地减少组织创伤; · 聚氨酯部分为所有ALZET泵型号提供最佳匹配,并可剪裁成所需的长度; · 压力释放导管连接可防止扭结并提高通畅性; · 可裁剪成合适的长度以达到最佳位置; · 无菌导管
|
|
* 所有专用导管均为无菌导管(ETO灭菌) |
|
可以根据需求,还选择颅内给药套管,采用体外微量注射的方法:
脑室微量给药导管可固定在大鼠、小鼠的颅骨上,埋入脑部适当的深度,配合相应的PE给药导管、微量注射器或者微量注射泵使用,实现对大鼠、小鼠颅内的微量给药。
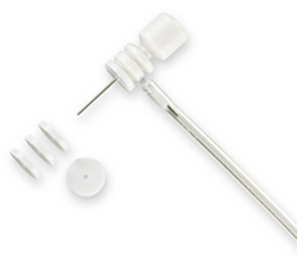
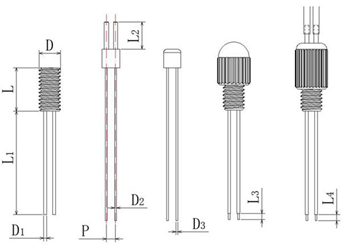
单套管颅内给药

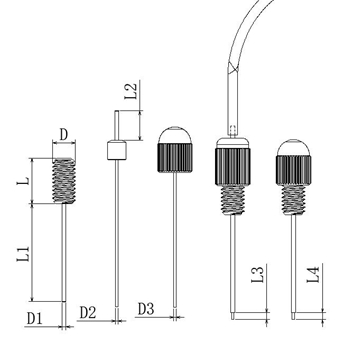
整个套管由基座、注射内管、导管帽、锁紧螺帽组成:

给药套管的详细构造及主要尺寸:
双套管颅内给药
适用于两种不同或相同的药物注射在两个不同的位置;
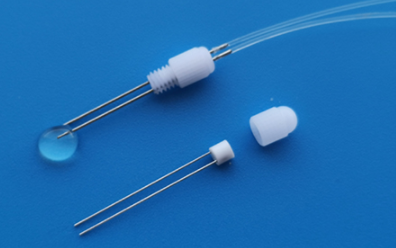
双套管的主要组成:

双套管的详细构造及主要尺寸:
参考文献:
[1] Wahis J, Baudon A, Althammer F, et al. Astrocytes mediate the effect of oxytocin in the central amygdala on neuronal activity and affective states in rodents[J]. Nature neuroscience, 2021, 24(4): 529-541.
[2] Zhu Z, Ng D W H, Park H S, et al. 3D-printed multifunctional materials enabled by artificial-intelligence-assisted fabrication technologies[J]. Nature Reviews Materials, 2021, 6(1): 27-47.
[3] Wang L, Gillis-Smith S, Peng Y, et al. The coding of valence and identity in the mammalian taste system[J]. Nature, 2018, 558(7708): 127-131.
[4] Terburg D, Scheggia D, Del Rio R T, et al. The basolateral amygdala is essential for rapid escape: a human and rodent study[J]. Cell, 2018, 175(3): 723-735. e16.
[5] Peng Y, Gillis-Smith S, Jin H, et al. Sweet and bitter taste in the brain of awake behaving animals[J]. Nature, 2015, 527(7579): 512-515.
[6] Tye K M, Mirzabekov J J, Warden M R, et al. Dopamine neurons modulate neural encoding and expression of depression-related behaviour[J]. Nature, 2013, 493(7433): 537-541.
[7] Sotres-Bayon F, Sierra-Mercado D, Pardilla-Delgado E, et al. Gating of fear in prelimbic cortex by hippocampal and amygdala inputs[J]. Neuron, 2012, 76(4): 804-812.
[8] Pascoli V, Turiault M, Lüscher C. Reversal of cocaine-evoked synaptic potentiation resets drug-induced adaptive behaviour[J]. Nature, 2012, 481(7379): 71-75.
[9] Lemos J C, Wanat M J, Smith J S, et al. Severe stress switches CRF action in the nucleus accumbens from appetitive to aversive[J]. Nature, 2012, 490(7420): 402-406.
[10] Goshen I, Brodsky M, Prakash R, et al. Dynamics of retrieval strategies for remote memories[J]. Cell, 2011, 147(3): 678-689.
[11] Aponte Y, Atasoy D, Sternson S M. AGRP neurons are sufficient to orchestrate feeding behavior rapidly and without training[J]. Nature neuroscience, 2011, 14(3): 351-355.
[12] Kravitz A V, Freeze B S, Parker P R L, et al. Regulation of parkinsonian motor behaviours by optogenetic control of basal ganglia circuitry[J]. Nature, 2010, 466(7306): 622-626.
[13] Amat J, Baratta M V, Paul E, et al. Medial prefrontal cortex determines how stressor controllability affects behavior and dorsal raphe nucleus[J]. Nature neuroscience, 2005, 8(3): 365-371.
[14] Jasmin L, Rabkin S D, Granato A, et al. Analgesia and hyperalgesia from GABA-mediated modulation of the cerebral cortex[J]. Nature, 2003, 424(6946): 316-320.
[15] Sunter D, Hewson A K, Lynam S, et al. Intracerebroventricular injection of neuropeptide FF, an opioid modulating neuropeptide, acutely reduces food intake and stimulates water intake in the rat[J]. Neuroscience letters, 2001, 313(3): 145-148.
您想了解更多详细资料吗?
请与金年会联系:
TEL:,
QQ:3007536033
微信:yuyanbio
Mail:yuyanbio@126.com
欢迎您的咨询!


